| kotisivu |
| hakemisto |
| kartat |
| kohteet |
| teoriaa |
| fysiikkaa |
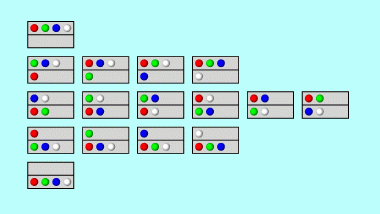
Tarkastellaan hyvin yksinkertaisena esimerkkinä säiliötä, jossa on neljä kaasuatomia. Jaetaan säiliö kahteen samanlaiseen osaan. Atomit voivat sijoittua näihin osastoihin seuraavilla tavoilla:

Tässä oleellista on vain se, miten atomit jakautuvat kahden osaston kesken; osastojen sisällä atomien järjestyksellä ei ole merkitystä. Erilaisia järjestyksiä on kaikkiaan 16 kappaletta. Vain yhdessä niistä kaikki atomit ovat yläpuolisessa osastossa. Tällaisen tilan todennäköisyys on siis 1/16. Samalla todennäköisyydellä kaikki atomit joutuvat alapuoliseen lokeroon. Jos atomit sijoittuvat osastoihin satunnaisesti, vain kerran kahdeksassa tapauksessa kaikki osuvat samaan osastoon. Tilanne, jossa yksi atomi on toisessa osastossa, esiintyy kahdeksan kertaa, siis todennäköisyydellä 8/16 = 1/2. Tällainen jakauma on siis edellistä yleisempi. Atomien jakautuminen tasan molempiin osastoihin tapahtuu todennäköisyydellä 6/16.
Hyvin järjestynyt tila, jossa kaikki atomit ovat samassa osastossa, on siis epätodennäköisempi kuin tilat, joissa atomit ovat hajautuneet molempiin osastoihin. Järjestäytyneen tilan pieni todennäköisyys vastaa pientä entropian arvoa. Järjestyksen vähetessä ja atomien hajaantuessa todennäköisyys ja entropia kasvavat.
Todellisissa systeemeissä hiukkasten määrä on paljon suurempi kuin edellisen esimerkin tapauksessa, jolloin todennäköisyyksien erot tulevat hyvin suuriksi. Hyvin järjestyneen tilan todennäköisyys on silloin lähes nolla. Periaatteessa on mahdollista, että huoneessa olevan ilman molekyylit sijoittuvat huoneen yhteen nurkkaan, mutta tällaisen tilan todennäköisyys on niin pieni, ettei sellaista käytännössä tapahdu koskaan.
Suljetun systeemin entropia ei koskaan pienene termodynaamisessa prosessissa. Tämä tarkoittaa systeemin kehittymistä kohti todennäköisempiä ja vähemmän järjestäytyneitä tiloja. Jos entropia pysyy vakiona, prosessi on reversiibeli (käänteinen), ja voi siis tapahtua kumpaan suuntaan tahansa. Jos entropia kasvaa, prosessi ei ole reversiibeli, ja sen kehitys voi edetä vain yhteen suuntaa.
On oleellista, että kysymyksessä on suljettu systeemi, johon ei tuoda energiaa ulkopuolelta. Esimerkiksi maapallo ei ole sellainen, koska siihen osuu jatkuvasta Auringon säteilyä. Tällaisessa systeemissä lisäenergia voi tuottaa järjestystä ja aiheuttaa entropian pienenemistä.